ENGINEERINGNET.BE - In Texas, Verenigde Staten, explodeerde op 18 april 2013 een fabriek waar meststoffen geproduceerd werden.
De explosie was tot 70 km ver te horen. Op 29 april 1942 vond in Tessenderlo een gelijkaardige explosie plaats, waarbij een krater van 70 m breed en 23 m diep werd geslagen. Er vielen toen 190 doden en 900 gewonden.
Volgens sommigen ging het ook om een explosie van 150-200 ton NH4NO3, terwijl anderen vermoeden dat de explosie te wijten was aan een chemische stof die de Nazi’s wilden gebruiken als aandrijfmiddel voor de in ontwikkeling zijnde vliegende V-1 en V-2 bommen. Bij de explosie was de knal te horen tot in Antwerpen, 50 km verderop.
Ammoniumnitraat vormt met verontreinigingen (vooral zware metalen) slaggevoelige mengsels. In aanwezigheid van een brandstof/solvent en onder de juiste omstandigheden grijpt een explosieve reactie plaats waarbij waterdamp, stikstofgas en zuurstofgas worden gevormd:
2NH4NO3(v) ? 4H2O(g) + 2N2(g) + O2(g) (1)
Wanneer een vaste stof (bijvoorbeeld NH4NO3) bij een explosie integraal overgaat in de gastoestand, dan kan een enorm volume aan gas gevormd worden, wat resulteert in een gigantische lucht-verplaatsing en drukgolf. Onder standaardcondities (1 atm, 0°C) neemt 1 mol gas een volume in van 22.41 l. Om het volume dat ingenomen wordt door 1 mol gas bij hogere temperaturen te kennen, kan men gemakshalve gebruik maken van de Ideale Gaswet:
P.V = n.R.T,
waarbij P = druk in atm,
V = volume in l,
n = aantal mol gas,
T = absolute temperatuur in graden Kelvin (273.15 +°C), en
R = ideale gas constante
(0.08206 l.atm/mol.K).
De van der waals-vergelijking is exacter, maar complexer om te gebruiken. Al snel wordt duidelijk dat het volume ingenomen door 1 mol gas bij hogere temperaturen vele malen groter wordt. Bij 100°C wordt dat volume 30.6 l, bij 500°C ongeveer 63.4 l, bij 800°C ongeveer 88 l
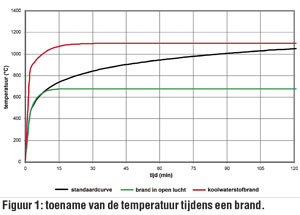
en bij 1000°C ongeveer 104.5 l. Bij een brand kan de temperatuur al snel boven de 1000°C uitstijgen, zeker in aanwezigheid van brandbare solventen (zie fig. 1). Bijgevolg zal bij hogere temperaturen een grotere hoeveelheid gas de omgevende luchtmassa moeten verdringen, wat resulteert in een grotere luchtverplaatsing en drukgolf.
1. Azides
In de chemische industrie en automobielsector worden ook andere explosieve stoffen zoals natrium-azide aangewend. Zo wordt 130 g natriumazide(NaN3, MW 65 g/mol) en enkele andere verbindingen gebruikt om een airbag op te blazen tot een volume van ongeveer 67 à 73 l.
Bij een zware botsing wordt het opblazen van de airbag geactiveerd doordat de natriumazide aanwezig in het stuurwiel wordt ontstoken door een klein en zeer snel werkend gloei-element. Het principe van de airbag berust dus op een explosieve reactie waarbij natriumazide ontbindt overeenkomstig de reactie:
2NaN3(v) ? 2Na(v) + 3N2(g) (2)
Azides worden ook gebruikt voor andere industriële toepassingen (bv. productie van farmaceutisch actieve stoffen). Ze kunnen reeds explosief ontleden bij verhitting boven hun smeltpunt (275°C). Vooral in aanwezigheid van sommige metalen (bv. koper, lood, zilver) kunnen azides slaggevoelige verbindingen vormen.

Wanneer er een explosie van natriumazide plaatsgrijpt, moet men er ook rekening mee houden dat het vrijgekomen natrium met water kan reageren met vorming van het brandbare en explosieve waterstofgas. Dit is een belangrijk gegeven wanneer na een explosie van natriumazide een brandweerinterventie plaatsvindt.
Direct water als blusmiddel aanwenden kan men maar beter niet doen. Maar sowieso zal het natrium met het in de lucht aanwezige vocht reageren, waardoor het gevormde waterstofgas een brand tijdelijk zal aanwakkeren. De reactie met het in de lucht aanwezige vocht zal echter meer geleidelijk gebeuren (lager risico op een tweede zware explosie) dan wanneer het plots met een grote hoeveelheid bluswater in contact komt. Eens de bulkmassa aan natrium is verdwenen, dan kan men de brand met water beginnen blussen.
Natriumazide reageert ook met zuren waarbij het giftige en ontplofbare waterstofazide wordt gevormd. Bij een eventuele explosie gebeurt volgende decompositie-reactie:
2HN3(vl) ? H2(g) + 3N2(g) (3)
2. Tetrazool-derivaten
Naast hun aanwending in de automobielsector (airbag) worden tetrazool-derivaten ook gebruikt in de fotografische industrie en ze komen ook voor als onderdeel in de actieve stof van verschillende farmaceutische producten (bv. losartan, valsartan).

Tetrazolen zijn organische stoffen bestaande uit een 5-ring waarin 4 naast elkaar liggende atomen stikstof en 1 atoom koolstof terug te vinden zijn. Veel tetrazolen, vooral in aanwezigheid van sommige metalen, zijn schokgevoelig. Bij een explosie ontbindt 1H-tetrazool overeenkomstig reactie (4).
Tetrazolen bezet met andere chemische groepen (zwavel-, chloor- en zuurstofhoudende groepen) ontbinden iets wat verschillend, met vorming van HCl, SO2, CO, CO2, etc. Welke reactieproducten gevormd worden, hangt af van de zuurstof-balans in de chemische reactie.
3. Zinkpoeder
Sommige chemische stoffen reageren explosief met water met vorming van grote hoeveelheden brandbaar waterstofgas. Zinkpoeder, als voorbeeld, reageert met water, en bij hitte wordt het zeer brandbare waterstofgas gevormd:
Zn(v) + 2H2O(vl) ? Zn(OH)2 + H2(g) (5)
Op 23 augustus 2012 was er een brand bij het zinkverwerkend bedrijf Umicore aan de Industrieweg te Heusden-Zolder. In een bedrijfshal waren paletten met erop gestapeld zakken gevuld met zinkpoeder aan het smeulen gegaan. Omdat zink niet mag geblust worden met water, werden de paletten met een bulldozer naar buiten gereden en uit elkaar getrokken (Fig. 2). Op die manier kon het vuur vanzelf doven.
4. Fosforpentachloride en fosforoxychloride
De vaste stof fosforpentachloride (PCl5) en de vloeistof fosforoxychloride (POCl3) worden gebruikt als chloreringsreagens om hydroxyl-groepen in moleculen te vervangen door een chloor-functie. Bij grote hoeveelheden van elk van deze stoffen worden bij contact met water gigantische hoeveelheden corrosief zoutzuur-gas gevormd, dat bijtend inwerkt op de ogen, huid en ademhalingsorganen.
PCl5(v) + 4H2O(vl) ? H3PO4(vl) + 5HCl(g) (6)
POCl3(vl)+3H2O(vl) ? H3PO4(vl)+3 HCl(g) (7)
Bij reactie van 1 mol fosforpentachloride (PCl5, MW 208.2 g/mol) met 4 mol water (H2O) worden 5 mol zoutzuur-gas (HCl, MW 36.5 g/mol) gevormd. Als 1000 kg PCl5 (vaak vervoerd in blauwe plastic vaten van 25 kg) in zijn volledigheid reageert met water dan wordt bij benadering zomaar eventjes 24000 mol zoutzuur-gas gevormd. In kilogram uitgedrukt is dit 876 kg zoutzuur-gas, of bij kamertemperatuur (25°C) in volume uitgedrukt 587 m3 gas. Bij reactie van 1 mol fosforoxychloride (POCl3, MW 153.4 g/mol) met 3 mol water (H2O) worden 3 mol zoutzuur-gas (HCl, MW 36.5 g/mol) gevormd. Als 1000 kg POCl3 in zijn volledigheid reageert met water dan wordt bij benadering zomaar eventjes 19550 mol zoutzuur-gas gevormd. In kilogram uitgedrukt is dit 713 kg zoutzuur-gas, of bij kamertemperatuur in volume uitgedrukt 478 m³ gas.
Wanneer een vrachtwagen geladen met 28 ton fosforpentachloride (PCl5) bij brand accidenteel wordt besproeid met water, dan kan een hoeveelheid zoutzuur-gas ontstaan die overeenstemt met 24545 kg, of bij kamertemperatuur in volume uitgedrukt 16445 m³ gas. Dit is het volume gas dat bij 25°C en 1 atm aanwezig is in een kubus met zijde 25.4?m. Omdat PCl5 met water exotherm ontbindt (d.w.z. met meer hitte-ontwikkeling), zal de temperatuur van dit gas doorgaans groter zijn, en bijgevolg ook het ingenomen volume.
Een tankwagen geladen met 28 ton van het hevig stekende fosforoxychloride (POCl3) bevat ongeveer 16470 l van dit product, gezien de dichtheid van fosforoxychloride ongeveer 1.7 kg/l bedraagt. Wanneer brandweerlui een volledige vrachtwagentank gevuld met 16470 l fosforoxychloride (POCl3) bij brand accidenteel met water beginnen besproeien, dan kan een hoeveelheid zoutzuur-gas ontstaan die overeenstemt met 19960 kg, of bij kamertemperatuur in volume uitgedrukt 13390 m³ gas. Dit is het volume gas dat bij 25°C en 1 atm aanwezig is in een kubus met zijde 23.7?m. Omdat POCl3 net als PCl5 met water exotherm ontbindt (d.w.z. met meer hitte-ontwikkeling), zal de temperatuur van dit gas doorgaans groter zijn, en bijgevolg ook het ingenomen volume.
Een vaste stof zoals fosforpentachloride vindt men zeker terug in één of meerdere van de opslagmagazijnen die ons land rijk is. Sommige overslagbedrijven en distributeurs zijn echter onvoldoende op de hoogte van de risico’s die dergelijke stoffen met zich meebrengen. Ook bij hen kan een brand uitbreken; en het accidenteel verkeerd reageren op een bepaalde brand (in dit geval met water) door de bedrijfs- of civiele brandweer kan de toestand verergeren in plaats van verbeteren. Als eerste reactie de waterkraan opendraaien kan een klein accident doen escaleren tot een ramp van ongeziene omvang.
5. Titaantetrachloride
Titaantetrachloride (TiCl4) is een kleurloze corrosieve vloeistof met een stekende geur. Het wordt gebruikt als uitgangsstof in de productie van titaan (Kroll-proces) en titaandioxide (wit pigment). Titaantetrachloride hydrolyseert zeer gemakkelijk, en met water grijpt een hevige reactie plaats waarbij het corrosieve waterstofchloride vrijkomt (zie fig. 3).
Reeds in contact met vochtige lucht ontstaan zoutzuurnevels via de volgende reactie:
TiCl4(vl) + 2H2O(vl) ? TiO2 + 4HCl(g) (8)
6. Hittegevoelige stoffen
Zwavelkoolstof (CS2), ethers, peroxides, hydrazine-derivaten en nitro-verbindingen worden best zover mogelijk van een hittebron opgeslagen. Dampen kunnen ontsteken door contact met hete opper-vlakken.
7. Solventen
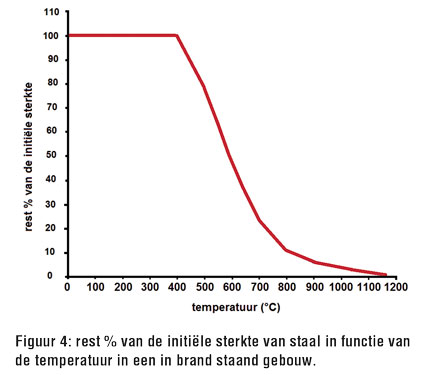
Uit Figuur 1 blijkt dat bij solventbranden de temperatuur binnen de 5 min tot 600°C oploopt (en tot 1100°C binnen de 8 min). Fig. 4 geeft het rest % van de initiële sterkte van staal weer in functie van de temperatuur. Bij 500°C houdt staal slechts 80% van zijn initiële sterkte over; bij 600°C houdt staal slechts 50% van zijn initiële sterkte over; en bij 800°C tenslotte bedraagt de reststerkte van staal slechts 10% meer van de oorspronkelijke sterkte.
Snel gebouwen verlaten
Men kan bij een ernstige brand/explosie maar beter zo snel mogelijk de gebouwen verlaten. Voor de veiligheid van de brandweerkorpsen is het bij een ernstige brand dikwijls beter een gebouw met chemicaliën gecontroleerd te laten afbranden, en vooral de overslag van de brand naar andere gebouwen, opslagplaatsen of de wijde omgeving te verhinderen.
Het grootste gevaar bestaat in de dikwijls onzichtbaar-brandende lekstromen die richting naburige tanks vloeien. Naburige tanks en vaten met solventen worden dan best koel gehouden met bluswater (zie fig. 5). Met stijgende temperatuur neemt de vluchtigheid van solventen toe, en kan er drukopbouw in de vaten en tanks plaatsvinden.
De druk in een tank kan enigszins op peil gehouden worden door de aanwezigheid van een ontluchting; maar solventdampen die dan via deze weg ontsnappen kunnen aangestoken worden.
Chemicaliën in voedingsbedrijven
In voedingsbedrijven vindt men gewoonlijk koel- en vriesinstallaties waarbij ammoniak gebruikt wordt als koudemiddel; en er worden ook aanzienlijke hoeveelheden reinigingschemicaliën (sterke basen, sterke zuren, etc.) en desinfectantia (perazijnzuur, waterstofperoxide, natriumhypochloriet, etc.) aangewend. Ammoniak is giftig; sterke zuren en basen zijn dikwijls corrosief; en perazijnzuur en waterstofperoxide zijn explosief.
Aanbevelingen voor chemische transporten langs de weg
Gevaarlijke chemische stoffen worden ook vervoerd per vrachtwagen, per spoor, per schip, per vliegtuig, etc. Het treinaccident in Wetteren op 4 mei 2013 (zie fig. 5) toont aan dat chemische transporten eveneens kunnen betrokken geraken bij een ongeval.

Daarom moeten de hulpdiensten (brandweer, politie, medische diensten, civiele bescherming) uiterst voorzichtig zijn bij het benaderen van brandhaarden waar chemische stoffen in betrokken zijn. Normaliter moeten de juiste chemische codes aangebracht worden op buitenzijde van transportmiddelen (bij chemische transporten langs de weg zijn dit de voor- en achterzijde, alsook de zijkanten van de vrachtwagen). De volledige verantwoordelijkheid voor het aanbrengen van de juiste codes op vrachtwagens ligt bij de transporteur.
De vraag stelt zich in hoeverre die transporteur op de hoogte is van de risico’s verbonden aan deze stoffen. Beschikken ook de buitenlandse transporteurs over de nodige kennis? Dienen vrachtwagenbestuurders bovendien niet opgeleid en gecertificeerd te zijn om dergelijke stoffen te vertransporteren? Het staat in ieder geval vast dat bestuurders van transportmiddelen (vrachtwagens, bestelwagens, etc.) geladen met chemische producten langs de weg voorzichtiger moeten zijn dan bij transport van niet-precaire goederen.
Is het ook niet beter om de volledige naam van het product voluit op de vrachtwagen te vermelden? Gevarensymbolen die wijzen op een brand-, explosie- en vergiftigingsrisico moeten op verschillende plaatsen van het transportmiddel aangebracht zijn; en het risico op de vorming van zeer corrosieve dampen en gassen zou klaar en duidelijk zichtbaar vermeld moeten worden op diverse plaatsen van het transportmiddel. Een gevarensymbool dat het gebruik van bluswater verbiedt (Fig. 6) zou eveneens aangebracht kunnen worden, om zo een ramp van ongeziene omvang te vermijden.
Tenslotte zou in elke brandweerwagen een boek met veiligheidskaarten aanwezig moeten zijn. In dat geval kunnen de brandweerlieden de risico’s verbonden aan een bepaalde stof of stoffen beter inschatten.
door Frank Moerman, KU Leuven
Bronnen
• Barton, J. & Rogers, R. (1997), ‘Chemical Reaction Hazards’, 2nd edition, Institution of Chemical Engineers
• Hertoghs, Jan (2009), ‘Zwarte woensdag, de vergeten ramp van Tessenderlo, Humo, nr 3582
• Hoffman, J.M. & Maser, D.C. (1985), ‘Chemical Process Hazard Review’, ACS Symposium series N° 274
• Scott, R.A. & Doemeny, L.J. (1987), ‘Design Considerations for Toxic Chemical and Explosives Facilities’, ACS Symposium series N°345.
• Vansant, E.F. (1997), ‘Cursus Veiligheidskunde’, Universiteit Antwerpen
• Vereniging van de Nederlandse Chemische Industrie (2011), ‘Chemiekaartenboek’, 26e editie









